天美娱乐、上海市绿色化学与化工过程绿色化重点实验室步文博教授与新加坡国立大学刘小钢教授、复旦大学附属华山医院姚振威教授的合作团队💫,受启发于临床肿瘤钙化点现象,巧妙借助于超小过氧化钙(CaO2)激活肿瘤细胞产生独特的“钙超载”生物学效应,首次提出了一类基于肿瘤细胞“钙死亡”的新型肿瘤治疗策略6️⃣:离子干扰疗法🌑。

步文博教授
众所周知,肿瘤患者在经历一段时期的化疗🏄👸🏻、放疗等系列治疗过程后,治疗效果显著的患者,其肿瘤病灶区域的CT影像会出现钙化点现象。
这类现象会常常引起临床医生的一个疑惑↕️📪,肿瘤病灶区的钙化发展与治疗效果是否存在必然联系呢😤🏄🏼?
从细胞生物学角度看,肿瘤钙化发展可能经历如下过程:对肿瘤病灶区放疗🪝、化疗—导致肿瘤细胞产生氧化应激—诱发肿瘤细胞钙超载—病灶区形成钙化点—最终导致肿瘤细胞死亡💇♂️。
而从材料学角度看,肿瘤病灶区产生的钙化点👩🏿🔬,其主要成分是羟基磷灰石(Ca5(PO4)3(OH))🕺🏽。因此🙅🏼♂️,将此经典的临床医学现象与材料科学相结合🧑🏿🔧🤬,也许会激发一类新型的肿瘤高效治疗策略✯。
近期🗓,天美娱乐、上海市绿色化学与化工过程绿色化重点实验室步文博教授与新加坡国立大学刘小钢教授、复旦大学附属华山医院姚振威教授的合作团队,受启发于上述的临床肿瘤钙化点现象,巧妙借助于超小过氧化钙(CaO2)激活肿瘤细胞产生独特的“钙超载”生物学效应🏋🏽♂️,首次提出了一类基于肿瘤细胞“钙死亡”的新型肿瘤治疗策略:离子干扰疗法(Ion Interference Therapy,IIT)👰♂️。国际权威学术期刊Cell姊妹刊Chem以“Calcium-Overload-Mediated Tumor Therapy by Calcium Peroxide Nanoparticles”为题,于2019年7月3日在线发表了这一最新研究成果。
Chem杂志题图
钙离子(Ca2+)作为细胞内信号传递的第二信使👩❤️💋👩,在调节机体多种生理功能过程中起到至关重要的作用🙆🏼,如细胞迁移和增殖、肌肉收缩😵💫、神经元兴奋等。
正常生理条件下👣,细胞受到外界信号刺激时,会引起细胞质中Ca2+浓度在空间和时间层面上的连续波动,以实现信号的精确传递。
细胞的许多功能都依赖于细胞质中的Ca2+浓度变化,一旦这种浓度改变不受控制🌉,细胞功能就会受到干扰🙎♂️,甚至引起细胞死亡。
比如,Ca2+在细胞质中的异常积累往往会引起细胞钙超载,而持续性的钙超载会进一步诱导细胞死亡。研究表明,在正常情况下,细胞对Ca2+浓度具有极其严苛的调控机制(ER/PR,钙泵✬,Ca2+通道等),使得细胞钙超载这一异常状态一般较难持续发生;
然而🧍♀️,在氧化应激状态下,细胞对Ca2+的调控能力将逐渐下降,导致Ca2+聚集而引发钙超载🙌🏿;降低氧化应激后🖥,细胞又可恢复到正常状态。细胞的氧化应激与钙超载1️⃣1️⃣,这两种状态还具有相互促进,互相增强的协同作用,这为基于钙超载的肿瘤高效治疗提供了的理论支持🧙🏻♀️。
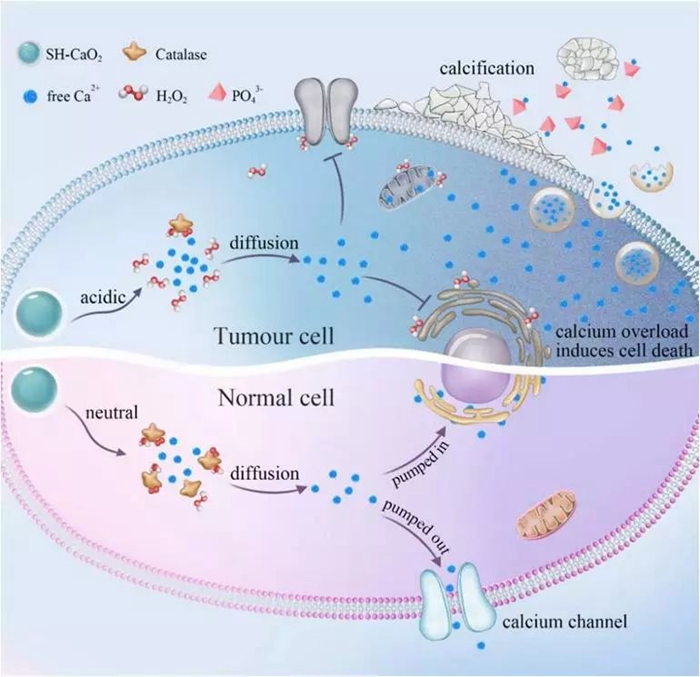
基于以上考虑,该合作研究团队采用一种简单的湿化学法,巧妙设计合成了一类粒径小于5nm的CaO2纳米颗粒📌,并在其表面包覆一层透明质酸钠,得到了超小SH-CaO2纳米颗粒🎅🏿。
在肿瘤病灶区中,SH-CaO2表面的保护层被透明质酸酶分解,暴露出的CaO2在肿瘤酸性微环境中可以加速分解☝🏽,快速产生过氧化氢和游离Ca2+。
由于肿瘤细胞中的过氧化氢酶表达下调🏉,导致由CaO2分解产生的过氧化氢在肿瘤细胞内大量累积,诱发肿瘤细胞产生氧化应激,氧化应激进一步导致Ca相关的离子通道的功能障碍🔊,无法正常调控肿瘤细胞内Ca2+浓度🐻,从而造成由过氧化钙分解释放的Ca2+在肿瘤细胞内长时间滞留,这种异常的Ca2+聚集行为将引发持续性的细胞钙超载👩🦲🚹,干扰或阻碍肿瘤细胞的代谢和增殖过程👖,诱导肿瘤细胞代谢紊乱以及功能性失调,从而诱导细胞死亡;
同时,Ca2+的局部富集还能促进肿瘤病灶区的钙化发展🫴🏽。这类由超小过氧化钙纳米颗粒诱发的肿瘤细胞死亡方式👩🏽🎓,在该研究工作中被定义为“钙死亡”(Calcicoptosis)。
这类新型的超小过氧化钙纳米药物具有以下几点优势:首先🤸♀️,由于Ca2+特殊的生物学效应存在于几乎所有的肿瘤细胞中❗️,因此,理论上该纳米药物用于肿瘤治疗具有普适性🏌🏽♀️;
其次,在正常细胞中✹,超小过氧化钙分解速度极其缓慢,缓慢分解产生的过氧化氢🧖🏻♀️,可以快速被过氧化氢酶分解为氧气和水🧍♂️,因此,无法诱发正常细胞产生氧化应激,进而解除了细胞“钙超载”应激反应📅,同时钙是人体必需元素,具有很好的生物安全性;
最后🥲,该纳米药物的室温合成工艺简单、便捷,适合批量化制备🙆🏿♂️。基于以上几点,随着“钙死亡”抑制肿瘤的分子学机制🤟🏻、药代动力学等基础研究的逐渐完善,预计这类新型的SH-CaO2纳米药物将具有极大的临床转化潜力📔。
目前🧑🏼🍳,各类无机纳米材料用于肿瘤治疗的研究已取得了很大进展,然而遗憾的是,无机纳米材料的生物相容性依然是阻碍其临床应用的瓶颈🧗🏼。
基于该工作中钙离子的特殊生物学效应,作者们认为可以利用纳米材料(包括无机纳米材料)自身降解产生的功能性离子或离子团簇的特殊生物学效应🤝,干扰或阻碍肿瘤细胞的代谢和增殖过程🙏,或者从广义上理解🐝👭🏻,通过调控生物活性离子与肿瘤细胞生理过程之间的相互作用,诱导肿瘤细胞代谢紊乱,从而起到抑制肿瘤生长、转移的作用。
这类新型肿瘤治疗策略被定义为👨🏼💼:离子干扰疗法(IIT),将为无机纳米材料在临床肿瘤治疗中的应用开辟新的途径🗻。
该研究成果得到了国家自然科学基金委、科技部🥟、上海市科学技术委员会等相关基金项目和人才计划项目经费的大力支持。
